Ліпіды
Ліпі́ды (ад грэц. λίπος, lípos — «тлушч») — тлустыя кісьлі, а таксама іхныя вытворныя, як паводле радыкалу, гэтак і паводле карбаксільнай групы.
Выкарыстоўваемае раней вызначэньне ліпідаў, як групы арганічных злучэньняў, добра рашчынальных у непалярных арганічных рашчынальніках (бэнзол, ацэтон, хляраформ) і практычна нерашчынальных у вадзе, зьяўляецца недакладным. Па-першае, такое вызначэньне замест слушнай характарыстыкі клясы хімічных злучэньняў кажа толькі аб фізычных уласьцівасьцях. Па-другое, у цяперашні час вядомая дастатковая колькасьць злучэньняў, нерашчынальных у непалярных рашчынальніках альбо, наадварот, добра рашчынальных у вадзе, якія, тым ня менш, адносяцца да ліпідаў. У сучаснай арганічнай хіміі вызначэньне тэрміну «ліпіды» заснавана на біясынтэтычнай роднасьці дадзеных злучэньняў — да ліпідаў адносяць тлустыя кісьлі і іхныя вытворныя. У той жа час у біяхіміі і іншых разьдзелах біялёгіі да ліпідаў па-ранейшаму прынята адносіць і гідрафобныя ці амфіфільныя рэчывы іншай хімічнай прыроды[1].
Асноўныя біялягічныя функцыі ліпідаў уключаюць здольнасьць да назапашваньня энэргіі, а таксама яны выступаюць у якасьці структурных кампанэнтаў вузных мэмбранаў[2]. Яны ўплываюць на пранікальнасьць вузаў і актыўнасьць многіх фэрмэнтаў, удзельнічаюць у перадачы нэрвовага імпульсу, у цяглічным скарачэньні, стварэньні міжвузных кантактаў, у імуннахімічных працэсах[3]. Ліпіды маюць шырокае прымяненьне ў касмэтычнай і харчовай прамысловасьці, а таксама ў галіне нанатэхналёгіяў[4].
Катэгорыі
[рэдагаваць | рэдагаваць крыніцу]Тлустыя ацылы
[рэдагаваць | рэдагаваць крыніцу]
Тлустыя ацылы ёсьць агульным тэрмінам дзеля апісаньня тлустых кісьляў, іхных спалучэньняў і вытворных. Яны ўяўляюць сабой разнастайную групу малекулаў, сынтэзаваных шляхам падаўжэньня ланцуга з ацэтыль-КоА праймэрам з групамі малёнілу-КоА або мэтыльмалёнілу-КоА. Гэты працэс мае назоў сынтэз тлустых кісьляў[5][6]. Яны складаюцца з вуглевадароднага ланцугу, які сканчваецца групай карбонавай кісьлі. Такая будова надае малекуле палярны гідрафільны канец і непалярны гідрафобны канец, нерастваральны ў вадзе. Структура тлустых кісьляў лічыцца адной з найбольш грунтоўных катэгорыяў біялягічных ліпідаў і звычайна выкарыстоўваецца ў якасьці будаўнічых блёкаў больш структурна складаных ліпідаў. Вугляродны ланцуг, звычайна даўжынёй ад 4 да 24 атамаў вугляроду[7], можа быць насычаным або ненасычаным і можа быць далучаны да функцыянальных групаў, якія зьмяшчаюць кісларод, галягены, азот і серку. Калі тлустая кісьля ўтрымлівае падвойную сувязь, існуе магчымасьць стварэньня цыс- альбо транс- геамэтрычнай ізамэрыі, што істотна ўплывае на канфігурацыю малекулы.
Падвойныя цыс-сувязі выклікаюць загіны ланцуга тлустых кісьляў, звычайна гэты эфэкт больш часты пры большай колькасьці падвойных сувязяў. Тры падвойныя сувязі ў 18-вугляроднай ліналенавай кісьлі, найбольш распаўсюджаным тлуста-ацыльным ланцугу расьлінных тылякоідных мэмбранаў, робяць гэтыя мэмбраны вельмі плыннымі, не зважаючы на нізкія тэмпэратуры навакольнага асяродзьдзя[8], а таксама прымушаюць ліналенавую кісьлю выразна паказваць рэзкія пікі ў 13С спэктрапіі ядзернага магнітнага рэзанансу хлярапластаў. Гэта, у сваю чаргу, адыгрывае важную ролю ў структуры і функцыі вузных мэмбранаў[9]. Большасьць прыродных тлустых кісьляў маюць цыс-канфігурацыю, але транс-форма існуе ў некаторых натуральных і часткова гідрагенізаваных тлушчах і алеях[10].
Прыкладамі біялягічна важных тлустых кісьляў ёсьць эйказаноіды, якія пераважна вылучаюцца з арахідонавай і эйказапэнтаэнавай кісьляў, якія ўтрымліваюць простагляндыны, леўкатрыены і трамбаксаны. Доказагексаэнавая кісьля таксама важная ў біялягічных сыстэмах, асабліва ў дачыненьні да зроку[11][12]. Іншымі асноўнымі клясамі ліпідаў у катэгорыі тлустых кісьляў ёсьць тлустыя этэры і тлустыя аміды. Складаныя этэры тлустых кісьляў улучаюць важныя біяхімічныя прамежкавыя прадукты, як то складаныя воскавыя этэры, вытворныя тыяэтэра тлустых кісьляў каэнзыма А, вытворныя тыяэтэра тлустых кісьляў ACP і карнітыны тлустых кісьляў. Тлустыя аміды ўлучаюць N-ацылэтаналаміны, як то канабіноідны нэўрамэдыятар анандамід[13].
Гліцэраліпіды
[рэдагаваць | рэдагаваць крыніцу]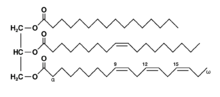
Гліцэраліпіды фармуюцца з мона-, ды- і трохскладных гліцэрынаў[14]. Найбольш вядомымі зь іх ёсьць трохэтэры тлустых кісьляў гліцэрыны, званыя трохгліцэрыдамі. У гэтых злучэньнях кожная з трох гідраксільных групаў гліцэрыны этэрыфікавана рознымі тлустымі кісьлямі. Паколькі яны выконваюць функцыю назапашвальніка энэргіі, гэтыя ліпіды складаюць асноўную частку запасу тлушчу ў тканках жывёлаў. Гідроліз складанаэтэрных сувязяў трохгліцэрыдаў і вызваленьне гліцэрыны і тлустых кісьляў з тлушчавай тканкі ёсьць пачатковымі этапамі мэтабалізму тлушчу[15].
Дадатковыя падклясы гліцэраліпідаў прадстаўленыя глюказілгліцэрынамі, якія характарызуюцца наяўнасьцю монацукрыдаў, злучаных з гліцэрынай праз гліказідную сувязь. Прыкладамі структураў гэтае катэгорыі ёсьць дыгаляктазілдыяцылгліцэрыны, якія можна знайсьці ў расьлінных мэмбранах[16], і сэміналіпіды, якія ўваходзяць да складу вузаў народкаў сысуноў[17].
Гліцэрафасфаліпіды
[рэдагаваць | рэдагаваць крыніцу]
Гліцэрафасфаліпіды, якія звычайна адносяць фасфаліпідаў, паўсюдна распаўсюджаныя ў прыродзе і ёсьць ключавымі кампанэнтамі ліпіднага пласту вузаў[18], а таксама удзельнічаюць у мэтабалізьме і вузнай трансдукцыі[19]. Нэрвовая тканка, уключна з той, якая зьмяшчаецца ў галаўным мозгу, зьмяшчае адносна вялікую колькасьць гліцэрафасфаліпідаў, і зьмены ў іхным складзе могуць справакаваць розныя нэўралягічныя разлады[20]. Гліцэрафасфаліпіды могуць быць падзеленыя на асобныя клясы паводле прыроды палярнай галаўной групы ў становішчы sn-3 асноўнага ланцуга гліцэрыны ў эўкарыётаў і эўбактэрыяў, або становішчы sn-1 у выпадку археяў[21].
Прыкладамі гліцэрафасфаліпідаў у біялягічных мэмбранах ёсьць фасфатыдылхалін, вядомы як лецыцін, фасфатыдылэтаналамін, вядомы як кефалін, і фасфатыдылсэрын. У дадатак да таго, што яны ёсьць асноўным кампанэнтам вузных мэмбранаў і месцамі, дзе лучацца ўнутры- і міжвузныя бялкі, некаторыя гліцэрафасфаліпіды ў эўкарыятычных вузах, як то фасфатыдыліназітолі і фасфатыдныя кісьлі, ёсьць альбо папярэднікамі, альбо самі ёсьць мэмбраннымі другаснымі пасродкамі[22]. Зазвычай, адна або абедзьве гэтыя гідраксільныя групы ацыляваныя доўгаланцуговымі тлустымі кісьлямі, але існуюць таксама гліцэрафасфаліпіды, зьвязаныя з алкільны і 1Z-алькеніламі (плязмаляген), а таксама варыянты дыалкільных этэраў у археяў[23].
Сфінгаліпіды
[рэдагаваць | рэдагаваць крыніцу]
Сфінгаліпіды ўяўляюць сабой складанае групу злучэньняў[24], якія маюць агульную структурную рысу, сфінгападобную аснову, якая сынтэзуецца de novo з амінакісьлі серыну і доўгаланцуговага тлустага ацылу-КоА, а затым ператвараецца ў цэраміды, фасфасфінгаліпіды, глікасфінгаліпіды ды іншыя злучэньні. Галоўную сфінгападобную аснову сысуноў звычайна называюць сфінгазінам. Цэраміды (N-ацыл-сфінгоідныя асновы) ёсьць асноўнай падклясай вытворных сфінгоідных асноваў з аміднай тлустай кісьляй. Тлустыя кісьлі звычайна бываюць насычанымі або монаненасычанымі даўжынёю ланцуга ад 16 да 26 атамаў вугляроду[25].
Асноўнымі фасфасфінгаліпідамі сысуноў лічацца сфінгаміеліны (цэрамідныя фасфахаліны)[26], у той час для вусякоў пераважна вылучаецца ўтрыманьне цэрамідных фасфаэтаноламінаў[27]. Грыбы зьмяшчаюць у сябе фітацэрамідныя фасфаіназітолі і групы, якія зьмяшчаюць манозу[28]. Глікасфінгаліпіды ўяўляюць сабой разнастайнае сямейства малекулаў, якія складаюцца з аднаго або некалькіх рэшткаў цукру, зьвязаных праз гліказідную сувязь з сфінгоіднай асновай. Прыкладамі іх ёсьць простыя і складаныя глікасфінгаліпіды, як то цэрабразыды і гангліязыды.
Стэрын
[рэдагаваць | рэдагаваць крыніцу]
Стэрыны, як то халестэрын і ягоныя вытворныя, ёсьць важным кампанэнтам мэмбранных ліпідаў[29] поруч з гліцэрафасфаліпідамі і сфінгаміелінамі. Іншымі прыкладамі стэрынаў ёсьць жоўцевыя кісьлі і вытворныя[30], якія ў сысуноў ёсьць акісьленымі вытворнымі халестэрыну і сынтэзуюцца ў печані. Расьліннымі эквівалентамі ёсьць фітастэрыны, як то β-сытастэрын, стыгмастэрын і брасыкастэрын. Апошняе з памянёных злучэньняў таксама выкарыстоўваецца як біямаркер росту багавіньня[31]. Пераважным стэрынам у вузных мэмбранах грыбоў ёсьць эргастэрын[32].
Стэрыны ёсьць стэроідамі, у якіх адзін з атамаў вадароду замешчаны гідраксільнай групай у пазыцыі 3 вугляроднага ланцуга. Яны маюць агульную з стэроідамі тую ж зьлітую структуру ядра з чатырох колцаў. Стэроіды выконваюць розныя біялягічныя ролі, у тым ліку ўлучаюцца ў гарманальную і сыгнальную сыстэму. Стэроіды з васемнаццацьцю атамамі вугляроду (C18) уключаюць у сябе сямейства эстрагенаў, у той час як стэроіды C19 складаюцца з андрагенаў, як то тэстастэрон і андрастэрон. Падкляса C21 улучае гестагены, а таксама глюкакартыкоіды і мінэралакартыкоіды[33]. Сэкастэроіды, якія зьмяшчаюць розныя формы вітаміну D, характарызуюцца расшчапленьнем колца B асноўнае структуры[34].
Прэнолы
[рэдагаваць | рэдагаваць крыніцу]
Прэнолавыя ліпіды сынтэзуюцца з ізапэнтэнілдыфасфату і дымэтылалілдыфасфату, якія зьмяшчаюць пяць вугляродных атамаў ды пераважна атрымліваюцца з дапамогай мэвалёнавай кісьлі[35]. Простыя ізапрэноіды, як то лінейныя сьпірты, дыфасфаты і г. д., утвараюцца шляхам пасьлядоўнага далучэньня злучэньняў зь пяцьцю атамамі вугляроду і клясыфікуюцца ў залежнасьці ад колькасці гэтых тэрпенаў. Структуры, якія зьмяшчаюць больш за 40 атамаў вугляродаў, вядомыя як політэрпены. Важнымі простымі ізапрэноідамі ёсьць каратыноіды, якія дзеюць як антыаксыданты і як субстанцыя вітаміну А[36]. Іншымі біялягічна важнымі клясамі малекулаў ёсьць хіноны і гідрахіноны, якія ўтрымліваюць ізапрэноідны хвост, прымацаваны да хінанаіднага ядра неізапрэноіднага паходжаньня[37]. Прыкладамі гэтых клясаў ёсьць вітамін Е і вітамін К, а таксама ўбіхіноны. Пракарыёты сынтэзуюць поліпрэнолы, гэтак званыя бактапрэнолы, у якіх канцавая ізапрэноідная частка, прымацаваная да атаму кіслароду, застаецца ненасычанай, у той час як у жывёлаў поліпрэнолы (даліхолы) канцавы ізапрэноід скарочаны[38].
Цукраліпіды
[рэдагаваць | рэдагаваць крыніцу]
Цукраліпіды апісваюць злучэньні, у якіх тлустыя кісьлі зьвязаныя з асновай цукру, утвараючы структуры, сумяшчальныя з двухпластавай мэмбранай. У цукраліпідах монацукрыд замяняе аснову гліцэрыны, якая прысутнічае ў гліцэраліпідах і гліцэрафасфаліпідах. Найбольш вядомыя цукраліпіды — гэта ацыляваны глюкозамін субстанцыі кампанэнту ліпідаў А ліпаполіцукрыдаў у грамадмоўных бактэрыяў. Тыповымі малекуламі ліпідаў А ёсьць дыцукрыды глюкозаміну, якія вылучаюць зь сямью тлушчавымі ацыльнымі ланцугамі. Мінімальны ліпаполіцукрыд, неабходны для росту кішачнага прутку, — гэта Kdo2-ліпід А[39].
Полікетыды
[рэдагаваць | рэдагаваць крыніцу]Полікетыды сынтэзуюцца шляхам палімэрызацыі ацэтыльных і прапіянілавых субадзінак клясычнымі фэрмэнтамі, а таксама ітэрацыйнымі і шматмодульнымі фэрмэнтамі, якія маюць агульныя мэханічныя асаблівасьці з сынтазамі тлустых кісьляў. Яны складаюцца з мноства другасных мэтабалітаў і натуральных прадуктаў, а таксама маюць вялікую структурную разнастайнасьць[40][41]. Многія полікетыды ўяўляюць сабой цыклічныя малекулы, асновы якіх часта мадыфікуюцца шляхам гліказіляваньня, мэтыляваньня, гідраксіляваньня, затляненьня або іншых працэсаў. Многія шырока карыстаныя процімікробныя, проціпаразытныя і проціпухлінныя сродкі ёсьць полікетыдамі або вытворнымі ад іх, як то эрытраміцыны, тэтрацыкліны, авэрмэктыны і супрацьпухлінныя эпатылёны[42].
Крыніцы
[рэдагаваць | рэдагаваць крыніцу]- ^ «Липид». Роснано.
- ^ Subramaniam, S.; Fahy, E.; Gupta, S.; Sud, M.; Byrnes, R. W.; Cotter, D.; Dinasarapu, A. R.; Maurya, M. R. (October 2011). «Bioinformatics and systems biology of the lipidome». Chemical Reviews. 111 (10): 6452–6490. doi:10.1021/cr200295k. PMC 3383319. PMID 21939287.
- ^ Липиды / Л. Д. Бергельсон // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ^ Mashaghi, S.; Jadidi, T.; Koenderink, G.; Mashaghi, A. (02.2013). «Lipid nanotechnology». International Journal of Molecular Sciences. 14 (2): 4242–4282. doi:10.3390/ijms14024242. PMC 3588097. PMID 23429269.
- ^ Vance, J. E.; Vance, D. E. (2002). «Biochemistry of Lipids, Lipoproteins and Membranes». Amsterdam: Elsevier. — ISBN 978-0-444-51139-3.
- ^ Brown, H. A., ed. (2007). «Lipodomics and Bioactive Lipids: Mass Spectrometry Based Lipid Analysis». Methods in Enzymology. Vol. 423. Boston: Academic Press. — ISBN 978-0-12-373895-0.
- ^ Hunt, S. M.; Groff, J. L.; Gropper, S. A. (1995). «Advanced Nutrition and Human Metabolism». Belmont, California: West Pub. Co. — С. 98. — ISBN 978-0-314-04467-9.
- ^ Yashroy, R. C. (1987). «13C NMR studies of lipid fatty acyl chains of chloroplast membranes». Indian Journal of Biochemistry and Biophysics. 24 (6): 177—178. — doi:10.1016/0165-022X(91)90019-S. PMID 3428918.
- ^ Devlin 1997. С. 193—195.
- ^ Hunter, J. E. (11.2006). «Dietary trans fatty acids: review of recent human studies and food industry responses». Lipids. 41 (11): 967–992. — doi:10.1007/s11745-006-5049-y. PMID 17263298.
- ^ Furse, S. (2.12.2011). «A Long Lipid, a Long Name: Docosahexaenoic Acid». The Lipid Chronicles.
- ^ «DHA for Optimal Brain and Visual Functioning». DHA/EPA Omega-3 Institute.
- ^ Fezza, F.; De Simone, C.; Amadio, D.; Maccarrone, M. (2008). «Fatty Acid Amide Hydrolase: A Gate-Keeper of the Endocannabinoid System». Lipids in Health and Disease. Subcellular Biochemistry. Vol. 49. — С. 101—132. — doi:10.1007/978-1-4020-8831-5_4. ISBN 978-1-4020-8830-8. PMID 18751909.
- ^ Coleman, R. A.; Lee D. P. (03.2004). «Enzymes of triacylglycerol synthesis and their regulation». Progress in Lipid Research. 43 (2): 134—176. — doi:10.1016/S0163-7827(03)00051-1. PMID 14654091.
- ^ van Holde & Mathews 1996. С. 630—631.
- ^ Hölzl, G.; Dörmann, P. (09.2007). «Structure and function of glycoglycerolipids in plants and bacteria». Progress in Lipid Research. 46 (5): 225—243. — doi:10.1016/j.plipres.2007.05.001. PMID 17599463.
- ^ Honke, K.; Zhang, Y.; Cheng, X.; Kotani, N.; Taniguchi, N. (2004). «Biological roles of sulfoglycolipids and pathophysiology of their deficiency». Glycoconjugate Journal. 21 (1–2): 59—62. — doi:10.1023/B:GLYC.0000043749.06556.3d. PMID 15467400.
- ^ «The Structure of a Membrane». The Lipid Chronicles.
- ^ Berridge, M. J.; Irvine, R. F. (09.1989). «Inositol phosphates and cell signalling». Nature. 341 (6239): 197—205. — doi:10.1038/341197a0. PMID 2550825.
- ^ Farooqui, A. A.; Horrocks, L. A.; Farooqui, T. (06.2000). «Glycerophospholipids in brain: their metabolism, incorporation into membranes, functions, and involvement in neurological disorders». Chemistry and Physics of Lipids. 106 (1): 1—29. — doi:10.1016/S0009-3084(00)00128-6. PMID 10878232.
- ^ Ivanova, P. T.; Milne, S. B.; Byrne, M. O.; Xiang, Y.; Brown, H. A. (2007). «Glycerophospholipid identification and quantitation by electrospray ionization mass spectrometry». Lipidomics and Bioactive Lipids: Mass-Spectrometry–Based Lipid Analysis. Methods in Enzymology. Vol. 432. — С. 21—57. — doi:10.1016/S0076-6879(07)32002-8. ISBN 978-0-12-373895-0. PMID 17954212.
- ^ van Holde & Mathews 1996. С. 844.
- ^ Paltauf, F. (12.1994). «Ether lipids in biomembranes». Chemistry and Physics of Lipids. 74 (2): 101—139. — doi:10.1016/0009-3084(94)90054-X. PMID 7859340.
- ^ Merrill, A. H.; Sandoff, K. (2002). «Chapter 14: Sphingolipids: Metabolism and Cell Signaling». In Vance, J. E.; Vance, E. E. (eds.). «Biochemistry of Lipids, Lipoproteins and Membranes» (4th ed.). Amsterdam: Elsevier. — С. 373—407. — ISBN 978-0-444-51138-6.
- ^ Devlin 1997. С. 421—422.
- ^ Hori, T.; Sugita, M. (1993). «Sphingolipids in lower animals». Progress in Lipid Research. 32 (1): 25—45. — doi:10.1016/0163-7827(93)90003-F. PMID 8415797.
- ^ Wiegandt, H. (01.1992). «Insect glycolipids». Biochimica et Biophysica Acta (BBA) — Lipids and Lipid Metabolism. 1123 (2): 117—126. — doi:10.1016/0005-2760(92)90101-Z. PMID 1739742.
- ^ Guan, X.; Wenk M. R. (05.2008). «Biochemistry of inositol lipids». Frontiers in Bioscience. 13 (13): 3239—3251. — doi:10.2741/2923. PMID 18508430.
- ^ Bach, D.; Wachtel, E. (03.2003). «Phospholipid/cholesterol model membranes: formation of cholesterol crystallites». Biochimica et Biophysica Acta (BBA) — Biomembranes. 1610 (2): 187—197. — doi:10.1016/S0005-2736(03)00017-8. PMID 12648773.
- ^ Russell, D. W. (2003). «The enzymes, regulation, and genetics of bile acid synthesis». Annual Review of Biochemistry. 72: 137—174. — doi:10.1146/annurev.biochem.72.121801.161712. PMID 12543708.
- ^ Villinski, J. C.; Hayes, J. M.; Brassell, S. C.; Riggert, V. L.; Dunbar, R. (2008). «Sedimentary sterols as biogeochemical indicators in the Southern Ocean». Organic Geochemistry. 39 (5): 567—588. — doi:10.1016/j.orggeochem.2008.01.009.
- ^ Deacon, J. (2005). «Fungal Biology». Cambridge, Massachusetts: Blackwell Publishers. — С. 342. — ISBN 978-1-4051-3066-0.
- ^ Stryer, L.; Berg, J. M.; Tymoczko, J. L. (2007). «Biochemistry» (6th ed.). San Francisco: W. H. Freeman. — С. 749. — ISBN 978-0-7167-8724-2.
- ^ Bouillon, R.; Verstuyf, A.; Mathieu, C.; Van Cromphaut, S.; Masuyama, R.; Dehaes, P.; Carmeliet, G. (12.2006). «Vitamin D resistance». Best Practice & Research. Clinical Endocrinology & Metabolism. 20 (4): 627—645. — doi:10.1016/j.beem.2006.09.008. PMID 17161336.
- ^ Kuzuyama, T.; Seto, H. (04.2003). «Diversity of the biosynthesis of the isoprene units». Natural Product Reports. 20 (2): 171—183. — doi:10.1039/b109860h. PMID 12735695.
- ^ Rao, A. V.; Rao, L. G. (03.2007). «Carotenoids and human health». Pharmacological Research. 55 (3): 207—216. — doi:10.1016/j.phrs.2007.01.012. PMID 17349800.
- ^ Brunmark, A.; Cadenas, E. (1989). «Redox and addition chemistry of quinoid compounds and its biological implications». Free Radical Biology & Medicine. 7 (4): 435—477. — doi:10.1016/0891-5849(89)90126-3. PMID 2691341.
- ^ Swiezewska, E.; Danikiewicz, W. (07.2005). «Polyisoprenoids: structure, biosynthesis and function». Progress in Lipid Research. 44 (4): 235—258. — doi:10.1016/j.plipres.2005.05.002. PMID 16019076
- ^ Raetz, C. R.; Garrett, T. A.; Reynolds, C. M.; Shaw, W. A.; Moore, J. D.; Smith, D. C.; et al. (05.2006). «Kdo2-Lipid A of Escherichia coli, a defined endotoxin that activates macrophages via TLR-4». Journal of Lipid Research. 47 (5): 1097—1111. — doi:10.1194/jlr.M600027-JLR200. PMID 16479018.
- ^ Walsh, C. T. (03.2004). «Polyketide and nonribosomal peptide antibiotics: modularity and versatility». Science. 303 (5665): 1805—1810. — doi:10.1126/science.1094318. PMID 15031493.
- ^ Caffrey, P.; Aparicio, J. F.; Malpartida, F.; Zotchev, S. B. (2008). «Biosynthetic engineering of polyene macrolides towards generation of improved antifungal and antiparasitic agents». Current Topics in Medicinal Chemistry. 8 (8): 639—653. — doi:10.2174/156802608784221479. PMID 18473889.
- ^ Minto, R. E.; Blacklock, B. J. (07.2008). Biosynthesis and function of polyacetylenes and allied natural products». Progress in Lipid Research. 47 (4): 233—306. — doi:10.1016/j.plipres.2008.02.002. PMID 18387369.
Літаратура
[рэдагаваць | рэдагаваць крыніцу]- Devlin TM Textbook of Biochemistry: With Clinical Correlations. — 4th ed.. — Chichester: John Wiley & Sons, 1997. — ISBN 978-0-471-17053-2
- van Holde K. E., Mathews C. K. Biochemistry. — 2nd ed.. — Menlo Park, California: Benjamin/Cummings Pub. Co., 1996. — ISBN 978-0-8053-3931-4
