Атам

А́там (па-старажытнагрэцку: ἄτομος — «непадзельны») — маленечкая часьцінка рэчыва, найменшая часьцінка хімічнага элемэнту, што захоўвае ягоныя ўласьцівасьці. Атам складаецца з дробнага, але масіўнага ядра, якое нясе дадатны электрычны зарад, і шмат лягчэйшых электронаў, якія маюць адмоўны электрычны зарад і ўтвараюць вакол ядра электронныя абалонкі. Памеры атама нашмат большыя за памер ядра і вызначаюцца памерамі электронных абалонак. Ядро складаецца з аднаго або некалькіх пратонаў і шэрагу нэўтронаў. Толькі найбольш распаўсюджаны ў Сусьвеце элемэнт вадарод ня мае нэўтронаў. Пратоны і нэўтроны называюцца нуклёнамі. Нэўтроны ня маюць электрычнага зараду.
Больш за 99,94% масы атама знаходзіцца ў ядры. Парадак лінейных памераў атаму — 0,1 нм. Для параўнаньня таўшчыня чалавечага воласу — каля мільёну атамаў вугляроду. Гэта менш за любую даўжыню хвалі бачнага сьвятла, таму чалавечае вока ня можа ўбачыць атамы ў звычайным мікраскопе.
Фізычныя і хімічныя ўласьцівасьці атаму вызначаюцца ягонай будовай, якая апісваецца квантавымі законамі. Электроны атаму прыцягваюць пратоны ў атамным ядры электрамагнітнай сілай. Пратоны і нэўтроны ў ядры прыцягваюцца адзін да аднаго ядзернай сілай. Звычайна гэтая сіла мацнейшая за электрамагнітную сілу, якая адштурхвае дадатна зараджаныя пратоны адзін ад аднаго. Пры пэўных абставінах электрамагнітная сіла становіцца мацнейшай за ядзерную сілу. У гэтым выпадку ядро разбураецца і пакідае пасьля сябе розныя элемэнты.
Калі колькасьць пратонаў і электронаў роўная, то атам ёсьць электрычна нэўтральным. Калі колькасьць электронаў большая за колькасьць пратонаў, то атам мае адмоўны зарад і называецца адмоўным іёнам, або аніёнам. У адваротным выпадку атам, які мае дадатны зарад, называецца дадатным іёнам, або катыёнам. У залежнасьці ад кантэксту, кажучы пра атам, маюць на ўвазе як электранэўтральныя атамы, гэтак і іёны згаданага хімічнага элемэнту, або гавораць пра атам, каб адрозьніць нэўтральную часьцінку рэчыва ад іёну, які мае электрычны зарад. Колькасьць пратонаў у ядры, званая атамным нумарам, вызначае, да якога хімічнага элемэнту належыць атам. Напрыклад, кожны атам медзі зьмяшчае 29 пратонаў. Атамы з аднолькавай колькасьцю пратонаў, але рознай колькасьцю нэўтронаў называюцца ізатопамі элемэнту.
Атам можа далучацца да аднаго або некалькіх іншых атамаў з дапамогай хімічных сувязей, утвараючы хімічныя злучэньні, як то малекулы або крышталі. Здольнасьць атамаў аб’ядноўвацца і адшчапляцца ёсьць адным з чыньнікаў большасьці фізычных зьменаў, якія назіраюцца ў прыродзе. Вывучэньнем гэтых зьменаў займаецца навука хімія.
Уласьцівасьці атаму
[рэдагаваць | рэдагаваць крыніцу]Субатамныя часьцінкі
[рэдагаваць | рэдагаваць крыніцу]- Асноўны артыкул: Субатамная часьцінка
Першапачаткова слова «атам» мела значэньне часьцінкі, якая не падзяляецца на больш дробныя часткі. Аднак паводле сучасных навуковых тэорыях атам складаецца з драбнейшых, субатамных часьцінак, найбольш распаўсюджаныя зь якіх — электроны, пратоны ды нэўтроны. Найбольш распаўсюджаны ізатоп вадароду 1H складаецца толькі з электрону ды пратону.
Найлягчэйшай з гэтых трох часьцінак зьяўляецца электрон. Ён мае масу 9,11·10−31 кг, адмоўны электрычны зарад і настолькі малыя памеры, што іх немагчыма вызначыць сродкамі сучаснай фізыкі. Да вылічэньня масы нэўтрына электрон лічыўся найлягчэйшай часьцінкай з дадатнай масай спакою. Пры нармальных умовах электроны прыцягваюцца да дадатна зараджанага ядра электрамагнітнай сілай.
Пратоны ў 1836 разоў цяжэйшыя за электрон (1,6726·10−27 кг) і маюць дадатны электрычны зарад, што прымушае электроны прыцягвацца да пратонаў электрамагнітнымі сіламі. Колькасьць пратонаў у атаме называецца ягоным атамным нумарам. У 1920 року пратоны адкрыў Эрнэст Рэзэрфорд.
Нэўтроны ня маюць электрычнага зараду і ў 1839 разоў цяжэйшыя за электрон (1,6749·10−27 кг). Памеры нэўтронаў ды пратонаў блізкія, каля 2,5·10−15 м. Іх адкрыў у 1932 року ангельскі фізык Джэймз Чадвік.
Нэўтроны і пратоны разам называюцца нуклеоны. Маса ядра меншая за суму масаў ягоных складнікаў. Гэты факт мае назву «дэфэкт масаў».
У стандартнай фізычнай мадэлі лічыцца, што электрон не складаецца з драбнейшых часьцінак. Пратоны ды нэўтроны складаюцца з элемэнтарных часьцінак, якія завуцца кваркамі. Яны існуюць двух тыпаў і нясуць частковы электрычны зарад. Пратон складаецца з двух u-кваркаў (кожны зарадам +2/3) ды аднаго d-кварка (зарадам −1/3), нэўтрон — з адного u-кварка ды двух d-кваркаў. Праз гэта ў пратону ды нэўтрону розныя масы і наяўнасьць зараду.
Кваркі трымаюцца разам з дапамогай моцнага ўзаемадзеяньня (або моцнай сілы), забясьпечванага глюонамі. У сваю чаргу нэўтроны і пратоны трымаюцца разам у ядры ядзернай сілай — астаткавай моцнай сілай з крыху адрознымі асаблівасьцямі.
Ядро
[рэдагаваць | рэдагаваць крыніцу]- Асноўны артыкул: Атамнае ядро

Усе зьвязаныя нэўтроны і пратоны ў атаме, якія ўтвараюць атамнае ядро, называюцца нуклеонамі. Радыюс ядра прыкладна роўны фэмтамэтраў, дзе — сумарны лік нуклеонаў. Памер ядра значна меншы за радыюс атама, які мае парадак 105 фм. Нуклеоны трымаюцца разам кароткадзейным прыцягненьнем, якое называецца астаткавай моцнай сілай. На адлегласьцях да 2,5 фм гэтая сіла значна мацнейшая за сілу электрычнага ўзаемадзеяньня, якая адштурхоўвае аднайменна зараджаныя пратоны.
Атамы аднаго хімічнага элемэнта маюць аднолькавы лік пратонаў, называны атамным лікам. У межах аднаго элемэнта можа быць рознай колькасьць нэўтронаў, якая адрозьнівае ізатопы гэтага элемэнта. Сумарны лік нэўтронаў і пратонаў вызначае нуклід. Лік нэўтронаў адносна да пратонаў вызначае ўстойлівасьць ядра, і некаторыя ізатопы падлягаюць радыяактыўнаму распаду.
Пратоны, электроны і нэўтроны адносяцца да фэрміёнаў. Фэрміёны падпарадкоўваюцца прынцыпу Паўлі, які забараняетоесным фэрміёнам, напрыклад некалькім пратонаў, адначасна займаць аднолькавы квантавы стан. Такім чынам, кожны пратон ядра мусіць займаць квантавы стан, адрозны ад усіх іншых пратонаў; тое самае тычыцца і ўсіх нэўтронаў у ядры, і ўсіх электронаў у хмары.
Ядро, колькасьць нэўтронаў і пратонаў у якім адрозьніваецца, можа патэнцыйна пераходзіць у ніжэйшы энэргетычны стан шляхам радыяактыўнага распаду, пры якім колькасьць нэўтронаў і пратонаў збліжаюцца. Такім чынам, атамы з аднолькавымі лікамі нэўтронаў і пратонаў больш устойлівыя да распаду, аднак з павелічэньнем атамнага ліку ўзаемнае адштурхваньне пратонаў патрабуе большай прапорцыі нэўтронаў дзеля ўстойлівасьці ядра.
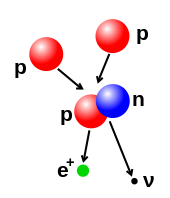
Лік нэўтронаў і пратонаў у атамным ядры можна зьмяняць, аднак гэта патрабуе надта высокай энэргіі празь дзеяньне моцнай сілы. Тэрмаядзерная рэакцыя адбываецца, калі розныя атамныя часьцінкі складаюць цяжэйшае ядро, напрыклад пры энэргетычным сутыкненьні двух ядраў. Так, у ядры Сонца пратоны пераадольваюць узаемнае адштурхоўваньне энэргіяй ад 3 да 10 кэВ — Кулёнаўскі бар’ер — і ўтвараюць адно ядро. Пры адваротным працэсе — дзяленьні — ядро падзяляецца на два меншыя ў рэакцыі радыяактыўнага распаду. Ядро можна зьмяніць таксама бамбардаваньнем высокаэнэргетычнымі субатамнымі часьцінкамі або фатонамі. Калі пры гэтым у ядры зьмяняецца колькасьць пратонаў, то атам пераўтвараецца ў іншы хімічны элемэнт.
Калі маса ядра па сканчэньні ядзернай рэакцыі меншая, чым сума масаў асобных часьцінак, то розьніца між двума гэтымі значэньнямі вызваляецца ў форме спажывальнай энэргіі (напрыклад, гама-выпраменьваньне або кінэтычная энэргія бэта-часьцінак), што апісваецца айнштайнавай формулай эквівалентнасьці масы і энэргіі e=mc², дзе m — зьмяншэньне масы, а c — хуткасьць сьвятла. Гэтая розьніца ідзе на энэргію сувязі новага ядра і ўтрымлівае злучаныя часьцінкі разам у такім стане, для разбурэньня якога зноўку патрэбная адпаведная колькасьць энэргіі.
Пры сынтэзе зь дзьвюх ядраў аднаго большага, які мае атамны нумар меншы, чым жалеза і нікель — то бок агульную колькасьць нуклеонаў да 60 — адбываецца экзатэрмічная рэакцыя, у якой вылучаецца энэргіі больш, чым патрэбна для злучэньня двух ядраў. Дзякуючы гэтаму працэс тэрмаядзернага сынтэзу ў зорках сам забясьпечвае сябе энэргіяй. З утварэньнем цяжэйшых ядраў энэргія сувязі на нуклеон пачынаецца зьмяншацца. То бок тэрмаядзерны сынтэз ядраў з атамным нумарам вышэй за 26 і масавым лікам вышэйшым за 60 ёсьць эндатэрмічнай рэакцыяй. Таму цяжэйшыя ядры не забясьпечваюць дастатковай колькасьці энэргіі для падтрымкі гідрастатычнай раўнавагі зоркі.
Электроны ў атаме
[рэдагаваць | рэдагаваць крыніцу]- Асноўныя артыкулы: Электронная канфігурацыя, электронная абалонка і атамная арбіталь
Электроны прыцягваюцца да атамнага ядра. Кожны электрон характарызуецца энэргіяй сувязі, якая вызначаецца адлегласьцю паміж ядром ды электронам. Гэтыя адлегласьці адпавядаюць атамным арбіталям.
Вонкавыя спасылкі
[рэдагаваць | рэдагаваць крыніцу]- Погляд унутар атаму. American Institute of Physics (анг.).
- Што такое атам? Live Science (анг.).

![{\displaystyle 1.07{\sqrt[{3}]{A}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a74a6ca6998768195969eef75ca046e8431c29d3)
