Акрылявая кісьля
| Акрылявая кісьля | |
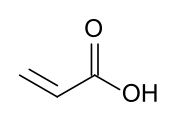 Структурная формула | |
 Кулестрыжневая мадэль | |
| Назвы | |
|---|---|
| Прап-2-эноевая кісьля
| |
| Іншыя назвы | Этыльэнэкарбаксыльная кісьля
|
| Агульныя | |
| Хімічная формула | C 3H 4O 2 |
| Зьнешні выгляд | чыстая бясколерная вадкасьць |
| Фізычныя характарыстыкі | |
| Агрэгатны стан | вадкі |
| Малярная маса | 72,063 г/моль |
| Пах | едкі |
| Шчыльнасьць | 1,051 г/мл г/см³ |
| Дынамічная вязкасьць | 1,3 (пры 20 °C) Па·с |
| Энэргія іёнізацыі | 1,7E−18 джоўль[3] |
| Тэрмічныя характарыстыкі | |
| Тэмпэратура плаўленьня | 14 °C |
| Тэмпэратура кіпеньня | 141 °C |
| Тэмпэратура ўспышкі | 68 °C |
| Тэмпэратура самаўспалымненьня | 429 °C |
| Рубеж выбуховасьці | 2,4 ± 0,1 % (V/V)[2] |
| Энтальпія ўтварэньня | −384,09 кіляджоўль на моль |
| Ціск пары | 3 ± 1 мм рт.сл.[2] |
| Хімічныя характарыстыкі | |
| pKa | 3 мм рт. сл. |
| Клясыфікацыя | |
| Рэгістрацыйны № CAS | 79-10-7 |
| PubChem | 6581 |
| № Эўрапейскай супольнасьці | 201-177-9 |
| SMILES | |
| InChI | |
| RTECS | AS4375000 |
| ChEBI | 18308 |
| ChemSpider | 6333 |
| Бясьпека | |
| Гранічна дапушчальная канцэнтрацыя | 2,4—8,02% |
| H-фразы | H226, H302, H312, H314, H332, H400 |
| Акрылявая кісьля ў Вікісховішчы | |
| Калі не пазначана іншае, усе зьвесткі прыведзеныя для стандартных умоваў (25 °C, 100 кПа). | |
Акры́лявая кі́сьля (ІЮПАК: прапэно́евая кісьля) — арганічнае злучэньне формулы CH2=CHCOOH. Найпрасьцейшая ненасычаная карбонавая кісьля, якая складаецца зь вінільнай групы, наўпрост злучанай з карбонакіслым канчаткам. Бясколерная вадкасьць з характэрным едкім ці даўкім пахам. Зьмешваецца з вадой, сьпіртамі, этэрамі і хляраформам.
Вытворчасьць
[рэдагаваць | рэдагаваць крыніцу]Акрылявую кісьлю атрымліваюць атляненьнем прапэну, які зьяўляецца пабочным прадуктам вырабу этылену і бэнзіну:
- 2 CH2=CHCH3 + 3 O2 → 2 CH2=CHCO2H + 2 H2O
Ранейшыя спосабы здабываньня акрылявай кісьлі і ейных эстэраў былі адкінутыя з прычыны неэканамічнасьці ці шкоды для вакольнага асяродзьдзя. Распрацоўваюцца спосабы атрыманьня кісьлі з прапану, значна таньнейшага за прапэн.
Рэакцыі і выкарыстаньне
[рэдагаваць | рэдагаваць крыніцу]Акрылявая кісьля праводзіць тыповыя рэакцыі карбонавых кісьляў. Пры рэакцыях з сьпіртамі ўтварае адпаведны эстэр. Эстэры і солі акрылявай кісьлі называюцца акрылятамі або прапэнаатамі. Найбольш распаўсюджанымі эстэрамі ёсьць мэтыл, бутыл, этыл і 2-этылгексылакрылят.
Акрылявая кісьля і ейныя эстэры лёгка спалучаюцца міжсобку (утвараючы поліакрылявую кісьлю) ці зь іншымі манамэрамі (акрылямідам, акрылянітрылам, злучэньнямі вінілу, стыролам і бутадыенам), утвараючы гомапалімэры або супалімэры, якія выкарыстоўваюцца ў вытворчасьці розных плястмасаў, пакрыцьцяў, клеяў, элястамэраў, масьцікі для падлогаў і фарбаў.
Бясьпека
[рэдагаваць | рэдагаваць крыніцу]Акрылявая кісьля выклікае значнае раздражненьне і разьядае скуру і дыхальную сыстэму. Пры трапляньні ў вочы можа пазбавіць зроку. Пры кароткім узьдзеяньні шкоды не наносіць, але працяглае ўдыханьне можа прывесьці да набраканьня лёгкіх. ЛД50 — 340 мг/кг (пацукі, аральна).
Акрылявая кісьля ўваходзіць у склад тытунёвага дыму.
Крыніцы
[рэдагаваць | рэдагаваць крыніцу]- ^ а б в ACRYLIC ACID (анг.)
- ^ а б в г д е ё ж з і http://www.cdc.gov/niosh/npg/npgd0013.html
- ^ а б в г д David R. Lide, Jr. Basic laboratory and industrial chemicals (анг.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ^ Bradley J., Williams A. J., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ^ Weast R. C. CRC Handbook of Chemistry and Physics (1st student edition) (анг.) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
